不同干预方式对ASD大鼠认知能力的影响及机制探讨
论文分类:

魏渼淇1刘忠民2冯广智1
(1.广西幼儿师范高等专科学校,南宁530000)(2.海南科技职业大学,海口570000)
【摘要】:目的观察有氧运动、丰富环境及二者结合对孤独症谱系障碍(ASD)大鼠认知功能和海马组织中ASD易感基因NRXN1、NL3和Shank3表达的影响,探讨其纠正自闭症异常行为的效果及其可能机制。方法采用向Wistar孕鼠腹腔注射丙戊酸钠建立ASD大鼠模型,选取40只成功建模的子代大鼠随机分为有氧运动组、丰富环境组、有氧+环境组以及ASD模型组,每组10只;在常规饲养的母鼠所产子代中随机挑选10只作为空白对照组。有氧运动组大鼠接受持续8周、6次/周、每次在同一时间段、持续90min的游泳运动干预;丰富环境组大鼠饲养于内有各种玩具、可供大鼠嬉戏玩耍的丰富环境饲养笼;运动+环境组接受运动干预,同时在丰富环境中饲养;ASD模型组和空白对照组不予干预。干预后,采用旷场实验和Morris水迷宫实验观察其行为学表现与改变;采用Westernblot检测大鼠海马组织中NRXN1、NL3和Shank3蛋白表达情况;采用RT-PCR检测大鼠海马组织中NRXN1、NL3和Shank3的mRNA表达水平。结果与空白组比较,ASD模型组、有氧运动组、丰富环境组及有氧+环境组的穿格次数少(P<0.05)、逃避潜伏期长(P<0.05)、原平台象限活动时间缩短(P<0.05),NL3、NRXN1和Shank3蛋白的mRNA表达均明显降低(P<0.05);与ASD模型组比较,有氧运动组、丰富环境组及有氧+环境组的穿格次数明显增加(P<0.05)、逃避潜伏期明显缩短(P<0.05)、原平台象限活动时间延长(P<0.05),大鼠海马组织中NL3、NRXN1、Shank3蛋白的mRNA表达均明显升高(P<0.05,有氧+环境组P<0.01);有氧运动组、丰富环境组及有氧+环境组相互比较,其穿格次数、逃避潜伏期、原平台象限活动时间与NL3、NRXN1和Shank3蛋白的mRNA表达均无显著性差异(P>0.05)。结论有氧运动、丰富环境及二者结合均可提高丙戊酸钠诱导的ASD模型大鼠的认知能力,一定程度纠正其异常行为,有氧运动结合丰富环境的干预效果优于单纯的有氧运动、单纯的有氧运动优于单纯的丰富环境。其作用机制可能与NRXN-NLGN-SHANK通路有关。
【关键词】:ASD;海马;NL3;NRXN1;Shank3
中图分类号:R-332文献标识码:A文章编号:1006-6179(2021)03-0047-07
∗基金项目:广西高校高水平创新团队-幼儿体质健康管理与服务资助项目;2020广西高校中青年教师科研基础能力提升项目(2021ky0959)
作者简介:魏渼淇(1995—),女,讲师,研究方向:体育保健.E-mail:477959500@qq.com
通信作万者:方冯广数智据(1988—),男,讲师,研究方向:体质监测.
孤独症谱系障碍(autismspectrumdisorder,ASD),也称孤独性障碍(autisticdisorder),是包括了典型孤独症、自闭症及其他社交功能障碍疾病的一种先天疾患。近几十年来,我国自闭症患儿数量日益增多,自闭症致残率的居高不下[1],给患儿家庭和社会造成了巨大的经济负担,改善自闭症的核心症状的研究显得十分迫切,因此许多研究者在积极寻找ASD的病因与治疗方法。体育运动干预作为一种便捷、有效的自闭症康复手段,近年来受到越来越多的重视。崔碧玉[2]研究证实运动健身活动干预对孤独症儿童具有正面的促进作用;张岚[3]研究证实体育运动和游戏相结合的康复训练能够提高ASD患儿的社交能力、耐力和运动能力。丰富环境[4]已证实可通过增强脑结构及功能可塑性进而改善个体的学习记忆和认知行为。周洁[5]研究显示丰富环境可逆转丙戌酸钠(VPA)诱导的ASD大鼠学习记忆功能异常。有氧运动可改善自闭症模型大鼠的学习记忆能力,显著提高PSD-95(postsynapticdensityprotein95,PSD95)在大鼠海马的表达水平,但其机制并不明确。PSD-95作为一种功能桥蛋白可将NRXN-NLGN-SHANK通路串连,此信号通路调控突触形成、传递、可塑性和成熟,其异常可能导致ASD发病[6]。本研究观察有氧运动、丰富环境及二者结合对ASD模型鼠认知能力的影响,并进一步选择与NRXN-NLGN-SHANK信号通路紧密相关的ASD易感基因NRXN1、NL3以及Shank3在大鼠海马组织的表达情况作为观察目标,以期为有氧运动、丰富环境及两者结合治疗自闭症提供新的理论基础和实验依据,并为基因通路治疗自闭症提供新的治疗策略。
健康成年SPF级Wistar大鼠40只,雌雄各半,雌性大鼠体质量175~225g,雄性大鼠体质量300~350g,购自吉林大学实验动物中心,实验动物生产许可证号:SCXK(吉)2016-0001,生产子代仔鼠(不限雌雄)共110只,实验用50只。动物实验场所:吉林大学基础医学院实验动物中心,实验动物使用许可证号:SYXK(吉)2018-0001。福利伦理审查编号:20190509。
VPA(碧云天生物科技有限公司);二甲基亚砜(BiologicalIndustries);台盼蓝细胞染料(北京鼎国生物有限公司);细胞裂解液(BD);胎牛血清(Corning);兔抗小鼠NRXN1和兔抗小鼠NL3(ThermoFisherScientific);Shank3多克隆抗体(艾美捷科技有限公司);RNA提取试剂盒、反转录试剂盒及实时定量PCR试剂盒(北京全式金生物科技有限责任公司);磷酸盐缓冲液和RNase-Freewater(Sigma)。红外旷场实验系统与Smart3.0全新行为学视频分析系统(东乐自然基因生命科学公司)Morris水迷宫(安徽淮化正华生物仪器设备有限公司);高速大容量离心机(BECKMAN);EthoVisionXT运动轨迹跟踪系统(赞德仪器有限公司);实时荧光定量PCR仪(ABI)。
选取健康成年Wistar大鼠40只,雌雄各半,于SPF环境中饲养一周。适应环境后,1∶1合笼过夜,次日将检查到阴栓的雌鼠换笼,进行隔离饲养。以见阴栓当日为怀孕第一天,记E1(embryonicday)。将16只受孕雌鼠随机分为两组,一组为模型组,另一组万为方对数照据组。模型组参照Schneider等[7]的建模方法,E12.5时对该组孕鼠按600mg/kg腹腔注射250mg/mLVPA,模型组子代仔鼠合计52只,其中经行为学检测成功可作为ASD模型鼠的48只,成模率92.3%。挑选40只运动ASD模型鼠,分为有氧运动组、丰富环境组、有氧+环境组以及ASD模型组,每组10只。对照组的孕鼠常规饲养,子代仔鼠合计58只,在其子代随机挑选10只作为空白对照组。
仔鼠出生一周后,进行ASD样行为学检测,与空白对照组相比,筛选出具有明显自闭症样行为的小鼠为ASD模型鼠。仔鼠出生当日为产后第1天,记PN1(postnatalday,PN)。
1.4.1方向趋向检测:于PN7~PN10对仔鼠进行检测,将仔鼠头朝向下方置于倾斜角度25°的光滑斜板上,记录其转身角度180所需时间。
1.4.2游泳行为实验:于PN8、PN10、PN12和PN15将各组仔鼠依次单独放入28℃的恒温水槽,观察5~10s,对其游泳能力进行评分并记录。评分标准:耳朵超过水位线,4分;水位线在耳朵中间,3分;鼻子超过或与水位线平齐,2分;鼻子在水位线下,1分。
有氧运动组:于PN31开始接受有氧运动干预,持续8周,6次/周;每次在同一时间段,持续90min的游泳运动;丰富环境组:于PN31饲养于内有各种玩具,可供大鼠嬉戏、玩耍及社交的丰富环境饲养笼中;有氧+环境组:于PN31接受运动干预,同时在丰富环境中饲养;空白对照组和ASD模型组:常规饲养,不予干预。
干预后,采用旷场实验和Morris水迷宫实验观察其行为学表现。
1.6.1旷场实验:在40cm的测试盒中进行,观察其行为学表现,旷场分为4场,共16个方格,中间的4个为中央区域,其余12个为周围区域。将大鼠分组放置中间区域开始实验,使用红外旷场实验系统监测5min,使用Smart3.0行为学视频分析系统统计穿格次数。
1.6.2Morris水迷宫实验:实验装置为一个圆柱形水桶,直径140cm×50cm及一个站台,直径为7cm。以桶两条互相垂直的直径将水池分为4个象限,以不同颜色的阿拉伯数字标记4个象限,将数字贴于水桶周围。将水温保持20~22℃,水深调节至40cm,将站台放置在第二象限中心且低于水面1~2cm处。实验前5d为定向航行阶段,此阶段每天进行4次训练,每次每只大鼠从不同象限进入水池。训练内容是将做好标记的大鼠从4个象限边缘中心点、面向水池壁轻放入水池,让其自主寻找平台,60s内找到平台的大鼠逃避潜伏期记为找到平台所用时间;60s内未找到平台的大鼠,用一根小木棍引导该大鼠至平台上停留,停留10s,记该鼠潜伏期为60s。训练结束后撤去平台,进行实验,将大鼠面向水池壁放入水池,进行巡航,采用EthoVisionXT运动轨迹跟踪系统记录大鼠60s探索水池轨迹,分析大鼠在原平台所在象限时间。
断颈处死大鼠,从枕骨大孔处打开颅腔,完整取出大脑,根据大鼠脑立体定位冰上剥离两侧海马,置取各组大鼠海马组织样本,采用RT-PCR检测大鼠海马组织中ASD易感基因NL3、NRXN1和Shank3的mRNA表达水平。根据总RNA小量制备试剂盒的步骤提取总RNA,根据逆转录试剂盒说明书进行逆转录,得到的cDNA按扩增流程进行扩增,在电脑上收集数据的程序是StepOneSoftwarev.2.2.2,在每一个循环中,延伸结束后收集荧光。扩增曲线中,横坐标为循环数,纵坐标为荧光强度。根据扩增曲线得出每个样品的Ct值(thresholdcycle,Ct值),由此算出基因的相对表达量(管家基因/参照基因:GAPDH)。引物序列见表1所列。

表1被测基因引物序列表
取冻存的海马组织置入匀浆器,PBS冲洗后加入蛋白质裂解液,冰浴同时研磨匀浆,裂解0.5h后,12000r/min、4℃离心5min。移液管吸取上清层至新EP管,-20℃保存。
1.8.2检测样品蛋白含量:BCA法测定。
1.8.3电泳:配制电泳所需的分离胶与浓缩胶,加入TEMED后灌胶,完成后用水冲洗,放入电泳槽。加样,每条泳道蛋白样品上样量为20μg,缓慢操作避免污染。电泳时,恒流200mA电流转膜,
1.10统计学分析
采用SPSS18.0软件进行统计学分析,实验数据以x±s表示,使用单因素方差分析,用P<0.05表示有显著性差异。
穿格次数:空白对照组>有氧+环境组>有氧运1.5h。1.8.4封闭:蛋白膜取出后TBS漂洗2min,TBST室温条件下封闭1h。
1.8.5抗体孵育:切蛋白条带后,加入TBST稀释后的一抗缓冲液(NRXN1、NL3和Shank3抗体,1∶3000;β-actin抗体,1∶3000),封口后,4℃孵育过夜。
1.8.6二抗孵育:TBST中洗涤5min,共洗3次,加入二抗缓冲液,4℃在侧摆摇床孵育1h(600r/min)后取出,放入TBST洗涤,洗膜3次,每次10min。动组>丰富环境组>ASD模型组。与空白对照组相比,有氧+环境组大鼠穿格次数较少,但差异不具有统计学意义(P>0.05),有氧运动组、丰富环境组及ASD模型组的穿格次数较少且差异具有统计学意义(P<0.05),其中ASD模型组差异显著(P<0.01);与ASD模型组比较,有氧运动组、丰富环境组及有氧+环境组的穿格次数明显增加(P<0.05);有氧运动组、丰富环境组及有氧+环境组三组间比较无显著差异(P>0.05)。见表2所列。

表2各组大鼠旷场实验穿格次数的比较
+较ASD模型组,有氧运动组、丰富环境组和有1.8.7图像分析:显色后,使用ImageLab系统进氧环境组逃避潜伏期明显缩短(P<0.05);较空白行图象扫描和结果分析。
Real-timePCR检测大鼠海马组织中NRXN1、N万L方3数和据Shank3的mRNA表达水平对照组,其余各组逃避潜伏期延长(P<0.05,P<0.01);有氧运动组、丰富环境组和有氧+环境组三组间比较无显著差异(P>0.05),结果见表3所列。
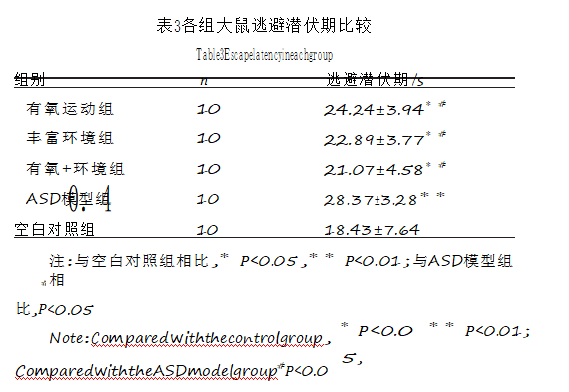
表3各组大鼠逃避潜伏期比较
(P<0.01);干预后,与ASD模型组比较,有氧运动组、丰富环境和有氧+环境组大鼠海马组织中NRXN1、NL3和Shank3蛋白表达水平升高(P<0.05),如图1~图4所示。

表4各组大鼠原平台象限活动时间比较
空白对照组1055.31±12.69#注:0与.空6白对照组相比,∗P<0.05,∗∗P<0.01;与ASD模型组相比,P<0.05
Note:Comparedwiththecontrolgroup,∗P<0.05,
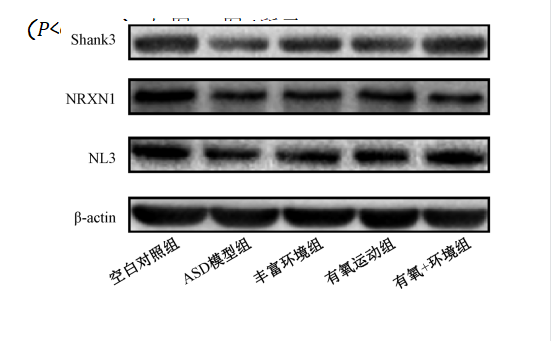
图1各组小鼠海马组织中NRXN1、NL3和Shank3蛋白表达电泳图Fig.1ElectrophoresisofNRXN1,NL3andShank3proteinexpressioninmousehippocampusineachgroup
原平台所在象限活动时间:空白对照组>有氧+环境组>有氧运动组>丰富环境组>ASD模型组。相
较于空0.白2对照组相比,有氧组及有氧+环境组大鼠穿原平台所在象限活动时间较短,但差异不具有统
计学意义(P>0.05),丰富环境组及ASD模型组的原平台所在象限活动时间明显缩短(P<0.05);相较于ASD模型组,其余4组大鼠在原平台所在象限游泳时间延长(P<0.05);有氧运动组、丰富环境组、有氧+环境组三组间比较无显著差异(P>0.05)。结果见表4所列。
NRXN1、NL3和Shank3蛋白表达水平与空白对照组比较,ASD模型组大鼠海马组织中NRXN万1、方NL数3据和Shank3蛋白表达水平明显降低

图2各组小鼠海马组织中NRXN1蛋白表达水平
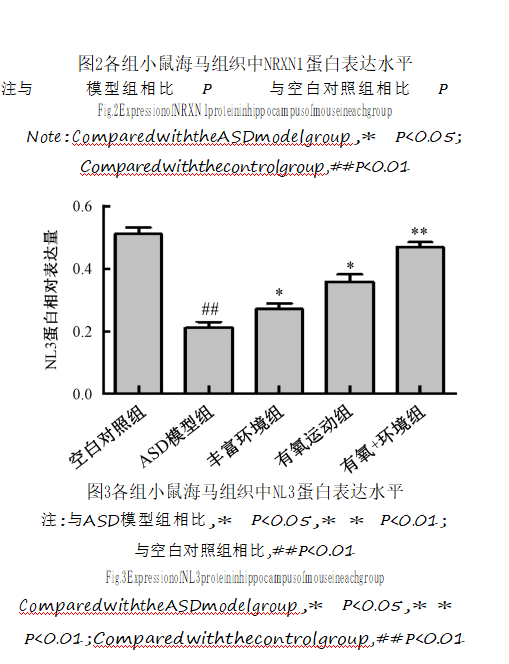
图3各组小鼠海马组织中NL3蛋白表达水平
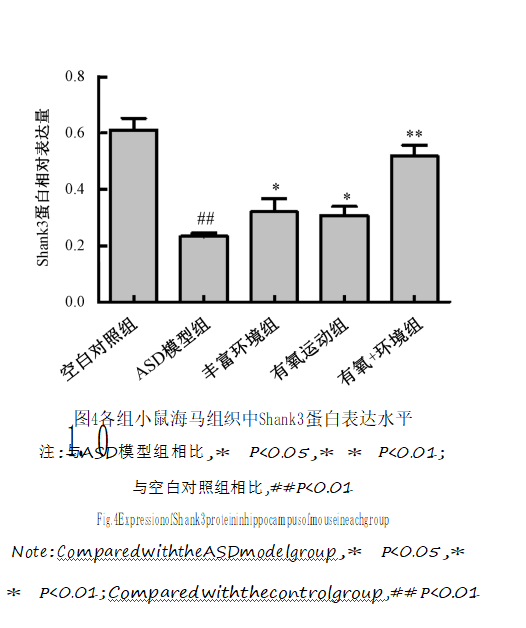
图4各组小鼠海马组织中Shank3蛋白表达水平
与空白对照组比较,ASD模型组大鼠海马组织中NRXN1、NL3和Shank3mRNA表达水平明显降低(P<0.01);干预后,与ASD模型组比较,有氧运动组、丰富环境和有氧+环境组大鼠海马组织中NRXN1、NL3和Shank3的mRNA表达水平升高(P<0.05)。如图5~图7所示。
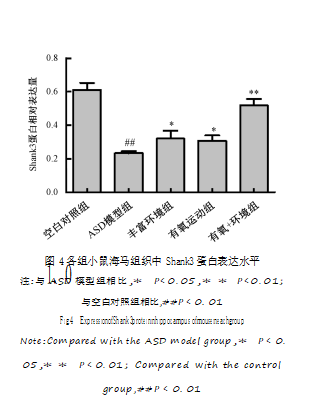
图5各组小鼠海马组织中NL3mRNA表达水平


图6各组小鼠海马组织中NRXN1的mRNA表达水平注:与ASD模型组相比,∗P<0.05;与空白对照组相比,7各组小鼠海马组织中Shank3的mRNA表达水平注:与ASD模型组相比,∗P<0.05;与空白对照组
本研究以VPA诱导的ASD模型鼠作为研究对象,此类模型在国内外针对自闭症谱系障碍的相关研究中被广泛应用[8],具有建模方法易操作、发病机制与人体患自闭症谱系障碍机制相似[9]的优点;
选取有氧运动、丰富环境刺激及二者结合作为干预手段,选取有氧运动作为干预手段是因为大量研究结果显示适量有氧运动可促进认知控制力发展、促进大脑认知健康[10],体育运动干预作为一种便捷的自闭症康复手段,不仅可以调节自闭症患者的身体,还能有效地提高自闭症患者的自信心,让自闭症患者更好地融入社会[11],而目前国内针对运动干预改善自闭症患儿相关症状的研究[12]较为少见,其具体干预效果与机制仍需进一步的实验验证。
本团队前期研究结果证明游泳运动、丰富环境及二者结合可以显著提高PSD-95在自闭症大鼠海马的表达水平,PSD-95作为功能桥蛋白可将NRXN-NLGN-SHANK间相互连接起来,主要参与调节NRXN-NLGN-SHANK信号通路。有研究显示,自闭症大鼠海马NL3蛋白表达与抑制性突触传递能力呈负相关[13],PSD-95的表达则会抑制因NL3蛋白诱导造成的抑制性突触的变化,当PSD-95与NL3共同表达则可平衡兴奋性突触与抑制性突触。与NL3相关的神经环路(NRXN-NLGN-SHANK)[14]的兴奋,缓解了相关突触的兴奋性与抑制性的失衡,影响海马区突触可塑性,并表现为认知功能和学习记忆能力的提高。NL3可与突触前膜的NRXN相互作用,还可与突触后Shank蛋白结合。其中,Shank3高表达于海马,其主要作用是促进树突棘形成、成熟,是形成功能性突触的必要基因。NRXN主要与突触的发生与发育、兴奋-抑制性突触的比例以及功能有关。自闭症谱系障碍患者普遍存在NRXN1错义突变。
本研究结果表明有氧运动、丰富环境及二者结合都可使ASD模型鼠海马组织中NRXN1、NL3和Shank3蛋白的mRNA表达上调,NRXN1、NL3和Shank3均处于NRXN-NLGN-SHANK信号通路中,且均为自闭症的易感基因。行为学实验结果显示经干预手段提供思路,为基因通路治疗自闭症提供了新的治疗策略,为“体医结合”提供新的推进思路。
【参考文献】
[1]GabisLV,AttiaOL,Roth-HananiaR,etal.Motordelay-Anearlyandmorecommon“redflag”ingirlsratherthanboyswithautismspectrumdisorder[J].ResDevDisabil,2020,104:103702.
[2]崔碧玉.健美操运动对自闭症儿童问题行为影响的个案研究[D].北京:北京体育大学,2019.
[3]张岚.体育游戏在自闭症儿童康复训练中的作用研究[J].体育世界(学术版),2019(7):151-152.
[4]李娅娜,李玲,江山,等.丰富环境及康复训练对创伤性脑损伤大鼠神经功能恢复的影响[J].中国康复医学杂志,2013,28(5):393-397.
[5]周洁.丰富环境逆转VPA诱导的ASD大鼠学习记忆功能异常[D].武汉:华东师范大学,2018.
[6]何龙楷,刘晓萍,宋燕燕,等.NRXN-NLGN-SHANK通路基因变异在自闭症谱系障碍发病机制中的作用[J].中华医学遗传学杂志,2018,35(5):753-756.
[7]SchneiderT,PrzewlockiR.Behavioralalterationsinratsprenatallyexposedtovalproicacid:animalmodelofautism[J].Neuropsychophar-macology,2005,30(1):80-88.
[8]李康.出生早期PM2.5暴露致大鼠自闭症样症状及其机制研究[D].北京:中国人民解放军军事科学院,2018.
[9]李怡心.自闭症模型大鼠各生长发育阶段的脑组织中m-GABAAR的表达情况及相关机制研究[D].重庆:重庆医科大学,2017.
[10]SmithPJ,BlumenthalJA,HoffmanBM,etal.Aerobicexerciseandneuroognitiveperformance:Ameta-analyticreviewofrandomizedcontrolledtrials[J].PsychosomMed,2010,72:有氧运动、丰富环境及二者结合干预的ASD模型鼠的运动协调能力、探究行为能力、空间记忆能力
[11]239-252.董继峰,杜文.体育锻炼对青少年自闭症康复治疗辅助作用研究[J].体育世界(学术版),2012(9):80-81.间学习能力等认知能力均有所提高,其自闭症核心症状,如社交障碍、重复刻板行为有明显改善,这可能与有氧运动、丰富环境及二者结合干预引发NRXN-NLGN-SHANK通路主要基因NRXN1、NL3和Shank3的变化,促进NRXN-NLGN-SHANK通路兴奋,矫正突触中兴奋和抑制电流不平衡,从而促进突触的形成及发育有关。自闭症的致病机制复杂多样,本研究为有氧运动、环境刺激及二者结合治疗自闭症提供新的理论基础和实验依据,为研发可改善自闭症核心症状的
[12]张芹.体育锻炼对轻度自闭症少年平衡能力的影响研究[J].牡丹江师范学院学报(自然科学版),2015(2):41-42.
[13]MartellaG,MeringoloM,TrobianiL,etal.Theneurobiologicalbasesofautismspectrumdisorders:theR451C-neuroligin3mutationhamperstheexpressionoflongtermsynapticdepressioninthedorsalstriatum[J].EurJNeurosci.,2018,47(6):701-708.
[14]BrignellA,StJohnM,BoysA,etal.CharacterizationofspeechandlanguagephenotypeinchildrenwithNRXN1deletions[J].AmJMedGenetBNeuropsychiatrGenet,2018,177(8)。


 最新文章
最新文章


佳木斯市


2020-03-09
2023-05-05
2023-09-22
2024-01-27
2020-12-03
2023-09-30
2022-12-26
2024-03-14


2023-02-20
2021-12-31
2023-07-26
2023-05-11
2023-07-19
2023-06-27
2023-11-16
2023-10-20


2020-07-09
2022-11-10
2023-04-19
2020-09-23
2023-07-06
2020-03-26
2023-02-17
2024-01-29


2024-02-26
2023-10-17
2024-02-19
2023-04-15
2023-07-10
2023-06-11
2023-12-19
2024-01-30
2023-07-19
2023-12-19
扫码拨打
在线咨询
微信客服
 微信客服
微信客服
微信公众号
 微信公众号
微信公众号






















