资讯分类导航:

微信扫一扫分享


DNA甲基化常见于胞嘧啶和CpG位点,是一种重要的表观遗传修饰的方式,可以在不改变DNA序列的情况下可逆地调节基因表达。
研究表明,孤独症患者CpG位点的DNA甲基化模式与健康对照不同。在胎盘组织中也发现这种差异,提示在胚胎神经发育过程中,表观遗传修饰可能参与影响神经系统发育。
神经网络处理信息的关键是保持兴奋(E)和抑制(I)的平衡。兴奋—抑制失衡也是导致孤独症的病理机制之一。γ—氨基丁酸(GABA)是一种抑制性神经递质,在维持E/I的平衡中起到非常重要的作用。
GAD1是调节GABA水平的关键基因,它可以编码催化GABA合成的谷氨酸脱羧酶异构体,因此GAD1是评价E/I平衡的关键生物标志物。
为了研究孤独症患者在胚胎发育过程中GAD 1甲基化模式的变化,研究人员利用来自孤独症患者和健康人的诱导多能干细胞(IPSCs)生成脑器官。用脑类器官对GAD1基因的已知调控靶区进行靶向DNA甲基化分析。
利用从全脑类器官中提取的DNA,研究人员进行了亚硫酸氢盐测序,以分析GAD1基因调控区的甲基化状态。
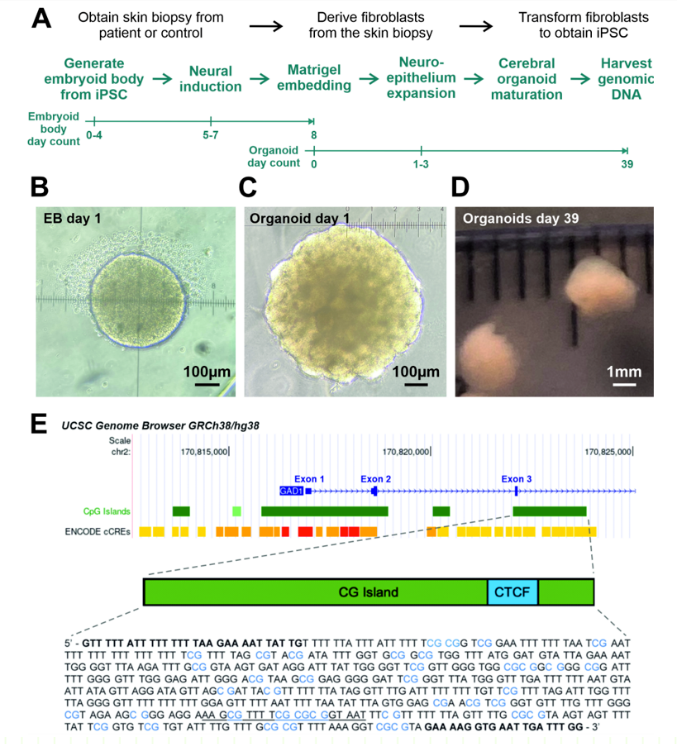
图一:脑类器官培养阶段和人类GAD1基因靶区
图1A:人类来源脑类器官的培养过程。
图1B:拟胚体培育第1天的图像示例。
图1C:脑类器官培养第1天的图像示例。
图1D:脑类器官培育第39天的示例图像,研究者收集此时脑类器官的基因组DNA用于GAD1甲基化分析。
图1E:图E是研究者进行甲基化分析的GAD1靶区,此研究分析了含有CTCF结合位点的CpG岛,已有研究证明该岛与人细胞中GAD1基因的转录相关。
图注:其中39个潜在的CpG甲基化位点显示为蓝色。下划线区域是CTCF结合序列。
本研究所用的脑类器官来自5名健康对照者和4名孤独症患者。研究人员通过亚硫酸盐测序分析了转录起始位点下游约3400bp处GAD1基因调控区的甲基化状态。
研究成果
对照组:研究人员在对照组中观察到显著的甲基化特征。
在随机挑选的克隆中,大多数(94.3%)的扩增产物甲基化水平较高。在5个对照类器官中,仅检测到1个甲基化<50%的扩增子克隆(图A)。
孤独症组:研究人员观察到,尽管绝大多数(90.3%)的克隆也显示出高水平的甲基化,4个孤独症组的大脑器官中有3个被检测到含有甲基化<50%的扩增子克隆(图B)。

图2:脑类器官GAD1靶区单个CpG位点的甲基化模式。
图2A:来自5名健康受试者的70个克隆。
图2B:来自4个孤独症患者的62个克隆。
此外,研究人员发现,孤独症组扩增子的DNA甲基化谱的多样性增加。为了进一步分析两组基因的甲基化状态,研究人员对甲基化>50%的优势基因组进行了差异分析。甲基化模式进行了进一步分析。
由于甲基化差异不仅存在于个体之间,也存在于不同的组织器官之间,研究人员亚克隆目标扩增子,以单细胞分辨率鉴定GAD1的DNA甲基化模式,并观察每组的共同点。
一、研究结果(如图3B)
孤独症组:11个克隆表现出独特的甲基化模式(模式7-17)。
对照组:只有1个克隆具有独特的甲基化模式(模式5)。
这表明,孤独症组中有很大一部分细胞具有独特的甲基化模式,与对照组不同。
二、研究成果的分析
孤独症组中甲基化水平的高度变化和CpG相关变异的增加表明,调控DNA甲基化的成分在发育过程中可能被破坏。
以往的研究表明,作为表观遗传途径的关键成分之一的双加氧酶(Tet)mRNA在成人孤独症患者大脑中的表达明显增加。此外,DNA甲基转移酶1(DNMT1)与GAD1在靶区上游区域的结合频率增加。
DNMT可以维持DNA甲基化,TET家族酶可以介导活性的去甲基化过程。
因此,研究人员推测,这两个关键的表观遗传成分在早期发育阶段的破坏增加了孤独症患者甲基化模式的多样性。
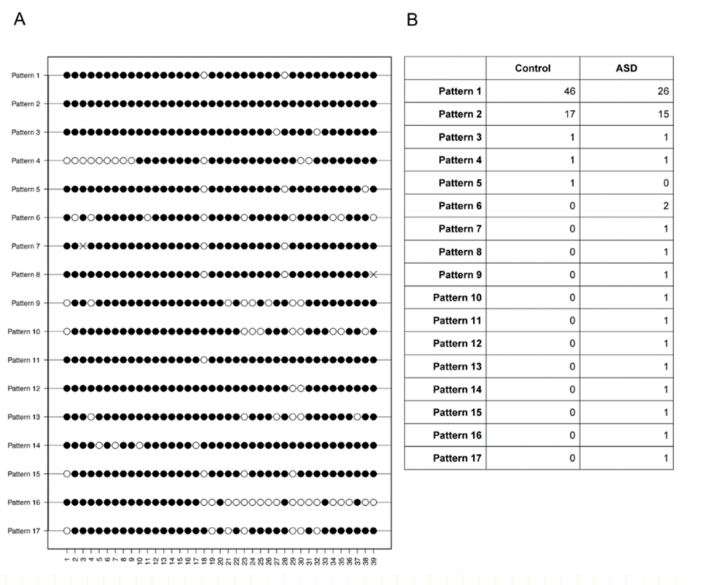
图3:在大脑类器官GAD 1靶向区域发现的DNA甲基化模式。
图3A:孤独症组和对照组DNA甲基化>50%的扩增子甲基化模式不同。
图3B:两组中每个DNA甲基化模式的克隆数。
为了进一步比较DNA甲基化特征的多样性,研究人员分析了扩增子甲基化率>50%的克隆中每个CpG位点的甲基化变异性。
一、研究成果
(1)孤独症组6个CpG位点的甲基化与对照组比较有显著性差异(图4A),孤独症组CpG位点的整体变异性增加(图4B)。
(2) 在孤独症组中,6个差异甲基化的CpG位点中有5个是低甲基化的。
(3)在6个CpG差异甲基化位点中,有3个位于CTCF结合位点。
二、研究成果的分析
在GAD1靶区,有一个CTCF的结合序列,CTCF是一种转录因子蛋白,可以与增强子和启动子相互作用来调节转录。当CTCF结合序列的DNA甲基化时,它可以通过阻止CTCF介导的多梳蛋白抑制复合物2的募集过程来激活GAD1的表达,导致GAD1转录增加和mRNA表达增加。
值得注意的是,研究结果发现,在孤独症患者中发现的6个差异甲基化CpG位点中,有3个位于CTCF结合位点,其余差异CpG位点也非常接近CTCF结合位点(上下100个碱基对以内),提示孤独症患者CTCF结合位点容易发生差异甲基化。
虽然位于CTCF结合位点的三个分化的CpG位点是连续的,但位点28是高甲基化的,而位点29和30是低甲基化的。这是一个异常,因为相邻的CpG位点通常应该具有相同的甲基化状态。
这表明虽然每个CpG位点的甲基化状态对CTCF结合序列的影响尚不清楚,但这三个位点的差异甲基化表明了孤独症患者器官中转录因子CTCF的结合靶点,序列的概率会发生变化。
此外,结果显示了CTCF结合序列中甲基化降低的总体趋势。因为如上所述,在正常情况下,当CTCF的结合序列发生甲基化时,DNA甲基化可以通过阻止CTCF介导的多梳蛋白抑制复合物2的募集过程来激活GAD1的表达,从而导致GAD1转录增加,mRNA表达增加。所以,CTCF甲基化的降低可以解释在孤独症患者中观察到的GAD1和GAD67的表达减少。
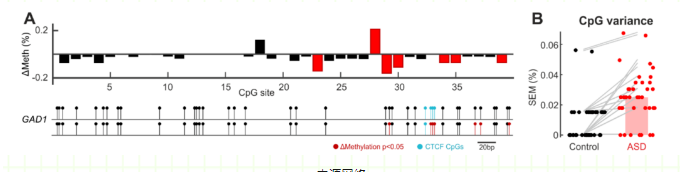
图4A上图:GAD1靶区CpG位点的差异甲基化。
图4A下图:将GAD1扩增子中的CpG位点定位到人类基因组。
图4B所示:孤独症组CpG位点的甲基化变异性增加。
图4A:每个CpG位点的差异甲基化为:(孤独症组的平均甲基化百分比)减去(对照组的平均甲基化百分比),因此正值反映了孤独症组相对于对照组的甲基化程度。
图4B
柱高:每个CpG点的中位数方差(SEM)。
灰色线:对照组和孤独症组在各CpG位点的对应差值。
1、小结
GABA能信号是维持神经回路兴奋抑制平衡的关键,神经回路经常发生在精神疾病如孤独症中。GAD1是调节GABA水平的关键基因,是评估兴奋-抑制平衡的关键生物标志物。
研究人员重点研究了GAD1的一个功能相关的调节区域,发现孤独症组大脑类器官靶区的DNA甲基化谱异常。
此外,通过分析孤独症患者和正常个体的甲基化模式,发现孤独症患者脑类器官中的GAD1甲基化谱失去了规律性。
2.讨论
不同类型的细胞有不同的DNA甲基化模式,大脑也不例外。不同类型的神经元亚群的基因也有特定的甲基化特征,如兴奋性神经元和抑制性神经元之间就存在特定的甲基化差异。
此前对孤独症患者脑类器官的研究也表明,这两类神经元存在特异性甲基化紊乱,与孤独症的进展有关。
鉴于GAD1可以调节抑制性神经递质GABA的水平,研究人员推断GAD1参与了特异细胞形成特有甲基化模式的过程。
因此,未来的研究方向可以通过分析特定类型细胞的甲基化模式,进一步了解在孤独症患者神经发育过程中,DNA甲基化异常和靶向表观遗传修饰异常对孤独症患者神经功能的影响。
本研究证明GAD1基因与孤独症相关,在孤独症患者胚胎发育阶段,GAD1受到表观遗传学调控。这项研究确定了6个潜在的GABA能生物标记物,其中3个位于功能相关的CTCF结合序列中。这些发现可以将被破坏的表观遗传修饰与孤独症患者大脑中的兴奋-抑制失衡联系起来。






2023-10-03
2023-08-04
2020-09-06
2020-03-08
2023-02-18
2024-03-10
2024-02-22
2020-08-29


2020-03-22
2023-03-19
2022-11-23
2023-09-12
2023-09-07
2020-09-01
2023-12-19
2024-01-29
扫码拨打
在线咨询
微信客服
 微信客服
微信客服
微信公众号
 微信公众号
微信公众号






















